La notizia è apparsa sui media qualche giorno fa. Lì per lì l’avevo lasciata andare, perché mi sembrava la solita solfa ‘aiuto moriremo tutti‘ che tanto piace ai media strilloni e poco porta alla conoscenza delle cose, quindi non volevo farle crescere le gambe.
Forse avevo fatto bene, ma sinceramente non resisto, perché all’allarme ingiustificato, come quasi sempre accade, si aggiunge anche l’ignoranza cronica con cui vengono normalmente recepiti e diffusi certi argomenti. E, ancora peggio, a menare le danze sono spesso reporter scientifici, che nuotano allegramente in questa ignoranza, certi del fatto che se amplificano il messaggio di allarme nessuno li correggerà, men che meno i cosiddetti ‘esperti’, che a quanto pare con l’allarme ci campano.
Andiamo con ordine. L’ANSA, ma anche Wired, Zeroemmission, BBC, e tanti altri ancora, tra cui anche un bel re-tweet di Nature Geoscience, hanno titolato così: L’acidificazione degli oceani mai così alta negli ultimi 300 milioni di anni. Urka, pesci, crostacei, molluschi et similia ci lasceranno le penne in un battibaleno! E, infatti, nelle varie trattazioni dell’argomento si parla proprio di estinzioni di massa che, udite udite, potrebbero essere già cominciate. L’ANSA, ma anche la BBC, nel corpo dei loro pezzi sottolineano che gli oceani non sono mai stati acidi come oggi.
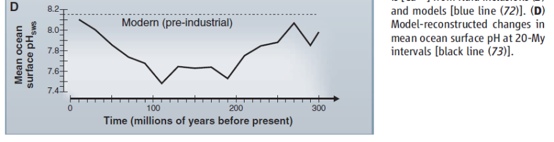
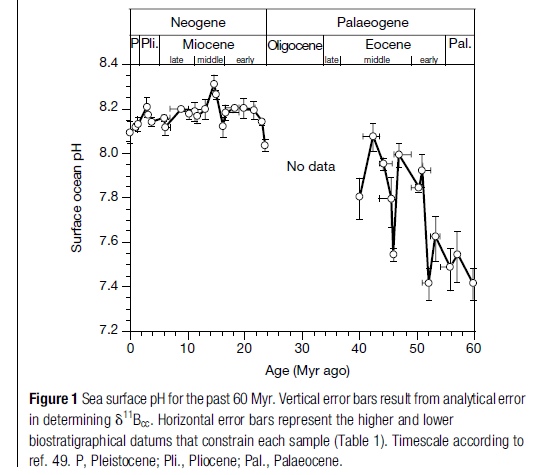
Le gambe a questa notizia le ha fatte spuntare un articolo di tale Fiona Harvey sul Guardian, riprendendo un report dell’International Programme on the State of the Ocean (IPSO) che in realtà si rivela essere una serie serie di paper messi insieme in uno special issue del Marine Pollution Bullettin, con abbondanti riferimenti bibliografici a cui attingere. Se a qualcuno fosse venuto in mente di dare un’occhiata almeno ai titoli e alle figure dei riferimenti più significativi, tipo questo e questo, si sarebbe rapidamente scoperto che per acidificazione si intende il rateo di diminuzione del pH e non il suo valore assoluto. Infatti, sempre nei riferimenti, c’è una messe abbondante di figure, tra cui quella sotto in particolare, che mostrano chiaramente che per la maggior parte degli ultimi 300 mln di anni, il pH degli oceani è stato più basso di ora, cioè di fatto gli oceani sono stati più acidi, pardon, meno basici, che è meglio.
Tra le altre cose, è pur vero che il pH degli oceani è in diminuzione, anche per effetto dell’aumento della concentrazione di CO2, ma è anche vero che almeno stando sempre ai riferimenti citati, con una risoluzione pari a 20 mlon di anni, risulta alquanto difficile capire se questo rateo di acidificazioen sia in accelerazione. Non a caso, è storia nota, ci sono stati nel passato remoto periodi con CO2 molto più alta di oggi, che quindi devono aver avuto oceani molto meno basici, periodi attraverso i quali, piaccia o no ai soliti strilloni, l’evoluzione degli ecosistemi ha fatto il suo corso, presentando di volta in volta vincitori e vinti a seconda dei casi. Se poi, in questi meccanismi di lunghissimo periodo, si vogliono innestare gli attuali scarsi 50 anni di dati osservati e raccolti con la rete per le farfalle e con margine di errore spaziale e assoluto molto più ampio della misura stessa si accomodino pure, ma, per l’ennesima volta, tanto gli strilloni quanto gli esperti in religioso silenzio assenso, fanno la figura dei cioccolatai, perché partono i titoloni sui giornali e nessuno si prende la briga di smentirli e spiegare come stanno effettivamente le cose.
Per la cronaca, questa analisi l’ha fatta Ruth Dizon sul suo blog, chiedendo anche spiegazioni a Nature Geoscience, che, sempre a mezzo tweet, ha risposto parlando di ‘interpretazioni problematiche’ e proponendo un grafico (sempre dai riferimenti disponibili), dal quale si evince che anche nei passati 60 mln di anni il pH degli oceani è stato per la maggior parte del tempo più basso di oggi. A seguire, anche Fiona Harvey del Guardian ha provveduto a rettificare. Molto bene, peccato che, nel frattempo, comunque, gli oceani siano oggi più acidi che negli ultimi 300 mln di anni. Googolare per credere!
Morale: non so cosa possa accadere nei prossimi otto o nove mesi, ma penso che anche la prossima estate si potrà andare al mare senza lo scafandro. Circa le letture da preferire in quei momenti di relax, direi che la lista si fa sempre più corta. Enjoy.


[…] 26 ottobre 2013 alle 12:26 Buon giorno a tutti , come avevo gia’ accennato al Sig Guido Guidi sono un’ appassionato di […]
Salve sig Donato , oggi pomeriggio ho eseguito una analisi di pH sull’acqua distillata da me prodotta 15 gg fa. Posso confermare analisi che avevo eseguito 16 anni fa (con valori relativamente piu’ bassi, anche se molto contenuti) l’acqua distillata da me prodotta è ricavata procedendo come segue:” l’acqua di acquedotto viene prima declorata con filtro a carboni attivi, poi passa in una serie di filtri denitrificanti etc ,decarbonatata , osmotizzata con osmosi inversa e poi distillata con distillatore in vetro e riscaldatore a piastre di quarzo.
Il campione di acqua che ho nelle spruzzette non è coperto da filtro per eliminare la CO2 (a differenza del serbatoio di stoccaggio ) quindi con il tempo si è carbonatata. Il risultato che oggi ho ottenuto con 3 pHmetri digitali differenti è inequivocabilmente pH 5,62(tutti i pHmetri sono stati tarati e calibrati con metodo ufficiale a norma UNI-ISO e CEN )
L’oservazione che lei fa è corretta, ma io gia’ mi sono riferito a 20°C ,(quindi sono stato bonario nelle misurazioni) … di conseguenza il fenomeno è piu’ accentuato a temperature inferiori.(il che aggraverebbe solamente la situazione di acidita’ dell’acqua distillata.)
Il discorso sugli oceani è molto piu’ complesso , e richiede un’analisi del fenomeno molto piu’ accurata, per vari motivi.
Comunque le annuncio (come gia’ avevo sottolineato poco sopra) che in condizioni di pH basico (ossia pH superiore a 7) il fenomeno di assorbimento CO2 si accelera notevolmente, proprio per la reazione di dissociazione dell’acido carbonico(H2CO3) che gia’ il gentile sig Guido Botteri aveva fatto presente .
La reazione è questa :” H2CO3 HCO3- + H+… tale reazione si sposta a destra sottraendo ioni H+ .
In ambiente alcalino (basico) lo ione H+ (che piu’ esattamente sarebbe H3O+) sottrae ioni ossidrili OH- ( che danno la basicita’) questa reazione (tra H+ e OH- ) da’ come risultato H2O , quindi H2CO3 si consuma , spostando ulteriormente a destra la reazione illustrata inizialmente nel primo post , cioè (CO2 + H2O H2CO3)
La basicita’ degli oceani è data dall’aragonite ,dalla calcite , dalla dolomite etc..(riserve di carbonio inorganico formatisi per reazioni degli elementi con CO2) comunque in poche parole da carbonati di calcio e magnesio
Il processo di scoglimento della calcite e dolomite in acqua con CO2 (che prende il nome di corrosione) è il seguente:
CALCITE CaCO3 + CO2 + H2O = (Ca2+) + (2HCO3-)
DOLOMITE CaMg(CO3)2 + 2CO2 + 2H2O = (Ca2+) + (Mg2+) + (4HCO3 2-)
In presenza di CO2 la solubilità della calcite è di circa 100 mg/l (alla temperatura di 25° ed una pressione parziale di CO2 di 10-3 bar), di poco inferiore è la solubilità della dolomite che è di 90 mg/l, alle stesse condizioni. Quello che li differenzia è la velocità con cui questo processo ha luogo che è nettamente inferiore per la dolomite.
Senza entrare nei dettagli si può dire che la solubilità delle rocce carbonatiche è tanto maggiore quanta più CO2 è presente nelle acque circolanti. L’acqua piovana ha in genere tenori di CO2 piuttosto bassi intorno a 2.3X10exp-4; nei suoli invece, a causa delle attività biologiche, si riscontrano tenori di CO2 piuttosto elevati (fino al 10%) e le acque attraversandoli, possono arricchirsi sino a livelli di qualche punto percentuale (una concentrazione così alta permette di scogliere mezzo grammo di calcare per litro).
Sono stato molto superficiale e non mi addentro nei fenomeni , ma le posso assicurare che il fenomeno è molto piu’ complesso di quel che ho descritto ora , e richiederebbe intere pagine, piu’ qualche nozione di chimica per la loro comprensione … (senza nulla togliere a nessuno e senza offese.Come diceva il sig Guido Botteri, ogni uno ha il suo Background ed il proprio bagaglio culturale). IO rimango a disposizione per chiunque voglia approfondire il discorso e saro’ lieto di rispondere ad ogni tipo di intervento .
(P.S. vorrei autocorreggermi sulla affermazione che avevo fatto in un post precedente e cioè: che il punto di saturo dell’acqua distillata avvenga con una concentrazione nell’aria dello 0,04% , non è cosi’ , è una mia svista , dimostrata oggi con l’ausilio del pHmetro(come dicevo sopra) , mi scuso per il banale errore) Miei colleghi mi staranno insultando … hahaha 🙂
Cordialita’
Francy
“Il discorso sugli oceani è molto piu’ complesso , e richiede un’analisi del fenomeno molto piu’ accurata, per vari motivi.”
.
Su questo non ci piove. E’ proprio la complessità del fenomeno che dovrebbe rendere più cauti coloro che sostengono che gli oceani si stanno acidificando. Noi stiamo parlando di reazioni chimiche (acqua distillata che si carbonata) in condizioni controllate: è come quando io faccio degli esperimenti con la rotaia a cuscino d’aria nel mio laboratorio di fisica. La realtà, però, è molto più complessa e di questa complessità bisogna tener conto studiando la vita reale.
Nel caso degli oceani ci troviamo di fronte ad acque molto più fredde dei 20° C del laboratorio per cui la solubilità della CO2 è maggiore. Se, però, aumenta il contenuto di calore degli oceani, aumenta anche la temperatura dell’acqua per cui, pur essendo fredda, dopo l’aumento di temperatura sarà meno fredda e, quindi, diminuisce la quantità di CO2 che essa è in grado di solubilizzare. Nel contempo aumenta la pressione relativa della CO2 atmosferica e, quindi, aumenta la quantità di CO2 che, statisticamente, attraversa la superficie di separazione aria-acqua. Quale di questi due fenomeni è prevalente? Non mi sembra che in letteratura siano disponibili risposte univoche.
.
“Comunque le annuncio (come gia’ avevo sottolineato poco sopra) che in condizioni di pH basico (ossia pH superiore a 7) il fenomeno di assorbimento CO2 si accelera notevolmente, proprio per la reazione di dissociazione dell’acido carbonico(H2CO3) che gia’ il gentile sig Guido Botteri aveva fatto presente .”
.
Anche su questo punto concordo, ma se aumenta l’acidità degli oceani (diminuisce il pH) l’accelerazione dovrebbe essere minore rispetto a quanto succedeva con valori di pH più alti. Ancora una volta ci troviamo di fronte ad un processo che tende ad auto-regolarsi: diminuisce il pH, diminuisce la capacità dell’acqua di assorbire CO2. Il problema, dal mio punto di vista è il seguente: è maggiore l’accelerazione della diminuzione del pH o quella della diminuzione della solubilizzazione della CO2?
.
“La basicita’ degli oceani è data dall’aragonite ,dalla calcite , dalla dolomite etc..(riserve di carbonio inorganico formatisi per reazioni degli elementi con CO2) comunque in poche parole da carbonati di calcio e magnesio”
.
Più CO2 in acqua, quindi, maggiore capacità di sciogliere calcite e dolomite e, alla fine, ambiente più basico: il sistema tende naturalmente a resistere allo spostamento dell’equilibrio chimico sciogliendo molta più calcite e dolomite.
E questo senza parlare delle alterazioni dei processi chimici indotte dai micro-organismi e dagli altri agenti biologici (cui, tra l’altro, si fa cenno nel commento).
.
Come si vede ci troviamo di fronte a dei feedback che non troviamo in laboratorio. Ed è proprio la comprensione di questi fenomeni che lascia molto a desiderare: una cosa è quel che succede in laboratorio, un’altra è ciò che succede nell’immensità degli oceani. In parole povere, il ciclo del carbonio, in natura è conosciuto solo qualitativamente, mentre gli aspetti quantitativi che lo riguardano sono solo stimati in analogia a quanto abbiamo scoperto in laboratorio: quanto è accurata ed affidabile questa stima? Le conoscenze sono accurate al punto da consentirci di assumere delle decisioni politiche, sociali ed economiche estremamente gravose con serenità d’animo e con cognizione di causa diversa dal principio di precauzione che, a mio giudizio, è solo un indice della nostra ignoranza piuttosto che di prudenza?
Ciao, Donato.
Certo sig Guido Botteri,ogni reazione chimica puo’ procedere nei 2 sensi, è una cosa abbastanza scontata per i chimici. La reversibilita’ di questa reazione , è specificata quando scrivo:
“Questo processo di acidificazione dell’acqua distillata viene denominato “carbonatazione” , è comune a tutti i laboratori di analisi, per decarbonatare l’acqua si utilizza il metodo della ebollizione per 15 minuti “.(per inciso ,la decarbonatazione è proprio il principio inverso alla carbonatazione)
L’andamento nei 2 sensi della reazione viene denominata “equilibrio chimico” , e come dice lei si puo’ spostare a destra o a sinistra agendo su 3 parametri , essi sono temperatura, pressione e concentrazione dei reagenti, meglio nota come legge dell’equilibrio mobile di le chatelier, e dalla legge di azione di massa di Waage e Guldberg .
Nel caso sopracitato ,la reazione chimica tra CO2 e H2O, puo’ essere spostata a sinistra aumentando la temperatura( i gas si sciolgono in modo minore a temperature piu’ elevate) , oppure diminuendo la pressione del sistema, oppure diminuendo la concentrazione di CO2 . In ogni caso i dati da me esposti sono a 20°C e a 760 mmHg (e mi scuso per non avere sottolineato questo aspetto) .
Per qualsiasi altra precisazione io sono qui , e ringrazio il blog per avermi dato la possibilita’ di esprimere le mie idee in modo sereno .
Cordialita’
Francy
Aumentando la temperatura degli oceani, quindi, dovrebbe diminuire la quantità di CO2 disciolta. Invece secondo molti studi sembra che tutto sia in aumento: l’acidità degli oceani, il contenuto di calore degli oceani, le temperature superficiali degli oceani, ecc., ecc..
Ciò che in tutto il discorso non mi convince, per cui mi definisco scettico 🙂 , è il non voler ammettere che il sistema climatico è dotato di meccanismi di autocontrollo in grado di ricreare l’equilibrio quando questo viene turbato. E, altra cosa che mi infastidisce in quella che è la linea di pensiero principale, è la negazione dell’esistenza di cicli naturali che oscillano tra condizioni di equilibrio variabili.
Ciao, Donato.
Francy, La ringrazio per la cortese risposta.
La mia specificazione, per banale che possa essere, ma non tutti sono chimici, va a beneficio di chi ha un background diverso, magari di tutto rispetto, ma diverso.
Ricambio volentieri le cordialità.
Guido Botteri
Buon giorno a tutti , come avevo gia’ accennato al Sig Guido Guidi sono un’ appassionato di chimica , quindi vorrei fare un paio di ragionamenti sulla CO2 .
Nell’ambito delle mie modeste conoscenze , posso affermare con tutta tranquillita’ che la CO2 presente nell’aria atmosferica fa variare il pH dell’acqua distillata che si utilizza normalmente nei laboratori chimici, ed è un fattore importante ,da considerare quando si eseguono analisi di titolazioni acido-base(molto comuni in ogni laboratorio chimico). Per inciso la variazione di pH , considerando una concentrazione in atmosfera dello 0,03%, varia da 7 a 5,7, diminuisce ancora a 0,04% a pH 3,8 (punto di saturo) . La reazione a cui si fa accenno è questa :CO2+H2O—–>H2CO3.
Per intenderci meglio , il consumo di NaOH 0,1N , per titolare 100 ml di questa acqua varia da 0,3 a 0,45 ml ,dando elevati errori nelle analisi chimiche sopramenzionate .
Per lo stesso motivo , le soluzioni basiche titolate di reagenti per analisi devono essere mantenute lontano dalla CO2 dell’aria ,di solito utilizzando dei filtri per CO2 da applicare sulla parte gas della bottiglia(tappo) .
Questo processo di acidificazione dell’acqua distillata viene denominato “carbonatazione” , è comune a tutti i laboratori di analisi, per decarbonatare l’acqua si utilizza il metodo della ebollizione per 15 minuti . Nel caso di soluzioni basiche ,il fenomeno si accelera notevolmente, e la soluzione non è recuperabile (quindi da buttare)
Invece sulle sostanze basiche solide il fenomeno è visibile ad occhio nudo .Esempio : la potassa solida lasciata all’aria secca partorisce delle “fiorette” di carbonato di potassio(date dalla reazione tra CO2 e KOH) , che a loro volta reagiscono con la CO2 per dare bicarbonato di potassio .
Aumentando le percentuali di CO2 nell’aria(quindi aumentando la pressione parziale) , questo fenomeno è maggiormente visibile e di intralcio alle comuni analisi di laboratorio.
Questa specificazione è solo per dare uno spunto di riflessione ed una conoscenza in piu’ su determinati fenomeni chimici che appartengono alla realta’ ed al nostro mondo.
I dati che ho citato li potete trovare su ogni libro di chimica analitica quantitativa.
cordialita’
Francy
Francy,
hai scritto
“CO2+H2O—–>H2CO3”
i laboratori chimici non sono il mio campo, e non entro nel merito, ma per quanto riguarda il clima, ricordo nel corso sul Riscaldamento Globale che seguii, che la reazione poteva andare nei due versi, e non solo da sinistra a destra.
Come anche si può vedere qui (trovato rapidamente su internet, non si riferisce al clima, ma serve ad illustrare che la reazione può avvenire nei due sensi):
http://spazioinwind.libero.it/claudioitaliano/equilibrio_acido_base.htm
“La formula:
CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+ illustra questo concetto. La reazione può andare in un senso o nell’altro, a seconda dei reagenti.”
Anche nel pianeta Terra la reazione può andare in un senso o nell’altro, a seconda dei valori in gioco.
Thanks for the link to my blog 🙂 I love your title (“Corrosive water or rusty journalism?” according to google translate).
You are right, this incorrect information about ocean pH is now all over the internet – it is depressing that neither scientists nor journalists seem to care about correcting it.
Cerco di essere breve, questi studi come tanti studi della nostra epoca di medioevo tecnocratico sono null’altro che aria fritta. Esattamente come per i cambiamenti climatici ormai orde di scienziati specialisti, persone evidentemente ignoranti in materia oltre che in qualche modo anche miopi e un po stolte continuano con questo modo di fare scienza che in realtà non è altro che uno sterile esercizio tecnico-matematico, supportato da grandi e complicati programmi di modellizzazione che creano realtà inesistenti che ci vengono vendute per certe reali e sicure. Anche in questo caso, il rateo o meglio la velocità di cambiamento è un parametro che valutato in questo modo non ha alcun senso. Esattamente come per i cambiamenti climatici e purtroppo con molti fenomeni naturali queste orde di ottusi “scienziati” continuano a non capire che non si posso confrontare dati e misurazioni dirette e puntuali ( in pratica quelle presenti e del passato storico) con dati indiretti e generali ricavati da analisi, studi interpretazioni di rocce sedimenti fossili e altro. Non si possono confrontare innanzitutto per le diverse scale temporali che abbracciano (ed è inutile fare correzioni, matematiche e informatiche sui numeri che si ricavano) e poi, cosa ancora piu importante per il diverso e significato che i dati e i “Numeri” ottenuti hanno nei due casi. RItorno al famoso master ginevrino sui GIS tenuto dal gotha dell IPCC . QUanti di questi diagrammi ho visto sulla variazione della velocità di variazione dei parametri; economisti e geografi che mi spiegavano che in epoca preistorica tutto era armonico ( mostrandomi splendidi grafici) mentre ora tutto è caotico, disarmonico, insomma il mondo è impazzito ( mostrandomi grafici con linee che si intersecavano da tutte le parti). MA per forza razza di imbe….illi state confrontando dati geologici che sono dati che forniscono delle medie spazio temporali con dati quotidiani che sono dati puntuali che misurano tutti i disturbi della variazione di una variabile, Il famoso smoothing che si fa su ogni genre di spettro per togliere il rumore di fondo, ecco loro fanno la stessa cosa prendon i dati geologici poi quelli delle misurazioni fanno vari smoothing e aggiustamenti matematici e poi si stupiscono se le 2 serie di dati non combaciano e attrribuiscono questa discrepanza all’uomo cattivo. Qui con gli oceani e il Ph siamo sullo stesso pezzo, Loro non misurano il Ph, bensi la velocità di variazione confrontando periodi di miloni di anni in cui i dati, geologici sono delle medie indirette di periodi proabilmente di 100-1000-10000 anni ( e di spazi interessanti interi bacini marini e oceanici) e poi cercano di confrontarli con misure orarie, quotidiane settiamanali mensili su un arco di 100 anni eseguite in un punto specifico di un mare o di un oceano, Ma come si fa, ma come il mondo scientifico puo permettere una tale aberrazione , una tale scemenza. QUeste cose, scusate mi fanno veramente andare in bestia.
Poi ricordo anche una presentazione al politecnico di Torino dove si discuteva proprio di acidificazione degli ocenai e scomparsa di specie viventi e gli studi presentati mostravano come in realtà gran parte delle specie viventi si adattavano a meraviglia a queste variazioni ( forse perchè sono sempre esistite? forse perchè la loro velocità nel passato a scala decennale o secolare è stata magiore di quella attuale?) Insomma in breve i vari ing. presenti si chiedevano il perchè di questa discprepanza tra il clima di allarme catastrofico e i dati reali per nulla preoccupanti. Ecco il succo del breve dibattito che venne fuori è che ci si rendeva conto che tutte quese paure fossero delle bufale, e che la stessa ricercatrice che aveva fatto lo studio aveva sentito come i suoi risultati non allarmistici fossero mal visti da una certa fetta di esperti e di come si sentissero un po emarginati in queto contesto…il famoso dagli all’untore e al miscredente , life motiv dogmatico dell’IPCC & C.
Evidentemente uno zoccolo di persone ottuse, ignoranti, volgari e arroganti in qualche modo in questi decenni deve aver preso il comando del sistema della ricerca e che ormani lo sta facendo andare alla deriva, come dimostra il fatto che si pubblica sempre di piu, in maniera esponenziale, mentre i progressi e le vere scoperte sicentifiche si sono ridotte quasi a zero.
Per me questi studi sono carta straccia, quindi se vogliamo fare del bene all’ambiente risparmiamo su queste idiozie e salvaguardiamo un po di alberi stampando meno carta da macero.
Mi perdoni Sig. Giovanni, non discuto le sue affermazioni, solo un po’ meno errori di battitura aiuterebbero a prendere in più seria considerazione quanto scritto. Grazie
“si pubblica sempre di più, in maniera esponenziale, mentre i progressi e le vere scoperte scientifiche si sono ridotte quasi a zero.”
mi sembra questa un’ottima sintesi di tanti articoli che leggiamo in giro, e doverosamente la metto in evidenza, anche perché coincide con la mia impressione.
Più si va verso l’allarmismo, più si va verso al decrescita, meno la scienza avanza, travolta dal pensiero comune, sostenuto dal consenso, invece che dai dati sperimentali (e spesso in opposizione ad essi).
Naturalmente questa non è la descrizione dell’intera scienza, grazie al cielo; altri settori si salvano ancora…ma per quanto ancora, visto che la serietà dei ricercatori che rispettano il metodo scientifico potrebbe essere sopraffatta dalla spinta ideologica, politica o degli interessi personali ?
Difendiamo il metodo scientifico, il rispetto della verità !
(al di là degli interessi personali che 2+2 faccia qualcosa di diverso da 4)
Secondo me.
Sta a vedere che verrà istituito un IPCC degli oceani, i quali cominceranno a gettare casse di Malox negli oceani come anti acido 🙂 …..nel frattempo potrebbero chiederci di non respirare in modo da non immettere anidride carbonica nell’aria nel caso fosse di natura antropica anche questo……Vi prego di perdonare le battute…ma nn ho resistito… 🙂